鄭燕淑研究員
壹、 前言
2023年,隨著中央健康保險署石署長的上任,為彌平過去健保新藥收載緩慢造成的新藥可近性與不及時等問題,提出了一系列的健保改革方案1,如藥價調整(DET)檢討方案、指示用藥給付政策、鼓勵學名藥及生物相似性藥使用及加速健保新藥收載(包含爭取以暫時性健保支付預算、檢討核價流程、優化醫療科技再評估制度、研議設立癌症新藥基金、成立醫療科技評估專責辦公室、推行新藥平行送審制度等方案)。在加速新藥收載議題上,健保署宣稱,成立醫療科技評估之專責辦公室可提升健保藥品收載之速度,若將健保收載及醫療科技評估相關事務委託專責辦公室辦理,可緩解健保署因人力不足以執行藥品相關業務上之困境2。2023年12月健保署正式成立「健康政策與醫療科技評估中心專責辦公室(Center for Health Policy and Technology Assessment, CHPTA)」,並推出「新藥平行送審」制度,目的就是希望透過這些變革加速新藥收載速度,提升健保藥品收載業務的行政效能。
2024年,賴總統上任後推出「健康臺灣」政策,讓醫療衛生相關的政策議題受到更多的關注,尤其在百億癌藥基金及降低癌症死亡率三分之一的政策目標,更與健保改革議題息息相關,顯示出健保藥品收載制度相關改革的重要性。因此,「百億癌藥基金」的政策目標更也在總統府層級的「健康臺灣」政策框架之下定調。
隨著2025年的到來,不論是專責單位、平行審查、暫時性支付或是百億癌藥基金政策,這些健保新政策都對未來有深遠的影響。現行推出的健保改革方案真的可以如期應用在未來制度之中?為了幫忙各界瞭解健保藥品收載政策,本文從醫療科技評估的角色與功能出發,檢視現行藥品收載的流程狀況。唯有理解當前運作問題,才能在新政策推行時避免重蹈覆轍,只有確保在所有環節都充分準備好了,並對實際問題提出解決方案,才能完善健保治理質量,提升健保運作效能及資源有效利用。
貳、 探討新藥收載程序前須先理解醫療科技評估是什麼
國際醫療科技評估組織聯盟(The International Network of Agencies for Health Technology Assessment, INAHTA)對「醫療科技評估」(Health Technology Assessment, HTA)的定義是指:「HTA是一個結合多種專業的過程,利用明確的方法學,評估特定醫療科技在其生命週期中某時點的價值。此過程的目標在於為決策者提供相關資訊,以促進發展一個平等、效率和高品質的醫療衛生體系。」我國採用「醫療科技評估」作為醫療衛生福利資源分配的時間可回推至2007年2008年間,此種評估方法至今已經廣泛運用在健保藥物給付項目及收載之程序。與藥物收載相關之利害關係人(主要為從事市場准入相關產業界人員)對醫療科技評估的應用及方法並不陌生。醫療科技評估制度存在的目的是為了協助政府部門在對醫療衛生福利進行資源配置(priority setting)的系統性評估工具。對於衛生主管機關及相關政策單位而言,這一評估制度不僅有助於資源配置,還能作為政策制定的參考依據。
參、 國際上之醫療科技評估組織簡介
世界各國中最早創立醫療科技評估系統的國家應該是澳洲,其主要負責機構為「澳洲藥品給付諮詢委員會(Pharmaceutical Benefits Advisory Committee,PBAC)」,PBAC於1945年成立,為政府預算支持的系統,主要負責藥物和醫療技術的臨床效益成本效益評估。直至1990年,PBAC開始要求所有納入醫藥福利計畫的藥物必須提供成本效益證據。1998年澳洲進一步擴展評估範圍,成立「澳洲醫療服務諮詢委員會(Medical Services Advisory Committee,MSAC)」,負責對醫療福利計劃和其他資助計劃中的醫療技術進行評估。澳洲與臺灣體制有相同的類似點,即一開始都是先從藥品的評估開始執行,之後再納入特材或醫療服務之醫療科技評估。
加拿大有兩個主要公共系統的醫療科技評估機構,一為「加拿大藥品及醫療科技評估機構(Canadian Agency for Drugs and Technologies in Health, CADTH)」,另一為魁北克省的「國家健康與社會服務卓越研究所(The Institut national d’excellence en santé et en services sociaux , INESSS)」。CADTH於1989年成立,其運作系統是由多層次的組織架構組成,涵蓋國家、省級和地區層面。2024年5月CADTH正式更名為「加拿大藥品評估中心(Canada’s Drug Agency, CDA)」。它主要的功能包括評估各種健康技術和藥物的效果及成本效益,訂定各種醫療科技評估相關指引及政策建議,協助醫療提供者及政策制定者瞭解最新的健康技術和藥物資訊。這兩項功能是國際醫療科技評估組織中最主要的功能範疇。另外,在知識共享及公眾參與部分也是專責醫療科技評估組織會思考的價值。
英國的「國家健康暨照護卓越研究院(National Institute for Health and Care Excellence, NICE)」是在1999年4月由英國衛生部(National Institute for Health Research, NHS)設立之單位,主要為協助英國衛生部提供全國性的建議,減少因地理位置或地區性不同衍生的治療差異,並訂定健康照護之相關準則以確保在不同地區之間提供的醫療照護品質一致。NICE基於證據,制定的準則和建議,而這些準則與框架?(framework)發揮某種程度的關鍵作用(可參考NICE發布的健康平等評論)3。NICE也歷經幾次組織內部運作的擴增與調整,雖如此,仍不影響其繼續扮演著提供NHS訂定並確保英國公民獲得高品質、有效率和公平的醫療和照護服務的角色。2012年,NICE從衛生部獨立成為非政府部門之公共組織(Executive Non-Departmental Public Bodies),類似於我國的行政法人。相較於政府單位,NICE在運作上擁有更多的獨立自主運作空間,其運作經費是來自英國衛生部每年編列的預算。歷經13年來,NICE內部的組織也隨著時代的演變而有所調整,部門數量、名稱及員工數也因時間不同而有所變化。透過在NICE網站上查尋到的資訊,NICE設有一個董事會(board)、執行團隊(executive team)及7個執行團隊(directorates)。董事會會制定組織的發展重點及政策框架,而執行團隊會執行日常決策的運作。
在英國NICE的組織架構下,與醫療科技評估有關的業務,則由醫療科技評估中心(Centre for Health Technology Evaluation, CHTE)負責,NICE對各執行團隊的業務職掌,也做了很清楚及細緻的分工。醫療科技評估中心(Centre for Health Technology Evaluation, CHTE)會針對全英國之照護體系所使用之新舊治療的藥物、醫療技術、醫療服務等相關治療制定指南,並負責藥品、醫療器材及醫療服務項目進行醫療科技評估,除此之外,CHTE也負責癌症基金運作事宜、提供病人准入計畫方案、諮詢服務、創新產品監控如何導入至醫療科技評估及醫療科技評估之選題方案等事務。CHTE不是被動的執行醫藥物的醫療科技評估,它們成立的目的並非是追求新醫療技術的發展,而是基於對英國醫療服務體系(NHS)對循證實踐(evidence-based)及對新舊科技之適當性需求的目標。4大部分的亞洲國家,如「亞洲醫藥科技評估聯盟(HTAsiaLink)」(泰國、馬來西亞、新加坡、韓國等)的會員國,在成立專責單位或建立相關醫療科技評估準則,會參考英國NICE的作法。因為英國的醫療科技評估制度有較詳盡的流程、評估準則及方法學或指南,這些準則也是各國在建立醫療科技評估制度(Health Technology Assessment, HTA)時會參考的主要機構之一。
泰國於2007年成立了健康干預與技術評估計劃(Health Intervention and Technology Assessment Program, HITAP),該計劃隸屬於泰國公共衛生部,主要負責協助訂定醫療衛生政策及資源分配。HITAP的核心目標包括:評估醫療技術和干預措施的有效性和成本效益、制定政策建議及促進公眾參與。
韓國5 於1977年通過《醫療保險法》,當時保險覆蓋率低,僅有政府官員、教師和大型企業的員工可能納入。1989年保險範圍才擴大至包括所有公民,包括農民和小型企業,實現全民人口覆蓋。推動全面覆蓋的過程中,最大的挑戰來自於公平性和預算的限制。韓國推動HTA的路徑與英國相似,為了實現公平性及可持續性的目標,希望藉由醫療科技評估的實證及成本效益評估方法,為政策做出明確的決策。2000年,南韓設立「韓國健康保險審查評價院(Health Insurance Review and Assessment Service, HIRA)」,在2006年至2007年間持續建立HTA相關的規則,與HTA相關的工作則由HIRA設立的HTA中心執行,並由「循證小組(Evidence-based Medicine Team)」負責新藥與非藥物技術的評估。在全民覆蓋的浪潮下,為擴大全民皆可享有健康政策的福利,在2008年底至2009年成立「韓國國家實證健康照護合作組織(National Evidence-based Healthcare Collaborating Agency, NECA)」,NECA專門負責醫療技術的評估,提供以實證科學支持的各項研究,作為醫療政策制定和資源分配的依據。NECA強調醫療科技評估的精神「以健康技術生命周期評估和有效的研究系統做準備」,支持國家醫療政策,在決策方面強化了其自身的角色,並與相關機構合作,使新醫療技術評估政策穩定並流程化。此外,NICA也是HTAsiaLink的創始成員國之一,積極參與建立亞太地區醫療技術評估機構的國際合作網絡。
韓國的新技術(藥品、特材或醫療服務)納入收載之流程,有三條路徑。第一條路徑為「新健康科技」(New health technology),首先必須先向「食品和藥品安全部(Ministry of Food and Drug Safety, MFDS)」申請查驗登記取得許可證。通過MFDS審查後,再由HIRA檢查新技術是否與已收載的項目重複,如確定為新技術,則由NECA進行安全性及相對療效評估。NECA完成評估後再由HIRA進行經濟觀點的評估,並由HIRA成立的專家評估委員會(Expert Assessment Committee)設定可收載的價格。國民健康保險服務(NHIS)則對藥品類技術進行價格談判。最後則由衛生部(Ministry of Health and Welfare, MOHW)根據評估結果,決定是否將新科技納入收載並公布。
第二條路徑為「創新性科技項目」(Innovative health technology)之有條件的快速給付通道(conditional fast track),此軌道專為缺乏足夠廣泛使用證據的健康技術而設計。有條件的允許條件是,它們必須在三年內充分積累數據後再重新進行評估。該通道的目的是在促進低使用率的創新技術的早期引入,針對稀有性、證據有限或需要成熟時間收集足夠證據的技術。因此,這種有條件的給付,允許在有限的時間內納入使用,透過收集上市後真實世界證據,避免新技術覆蓋決策的延遲。此種模式類似我國現在正在推行的「暫時性支付」制度相似。有條件給付的流程,大致上與第一條路徑相似,在NECA完成療效安全性及有潛力價值的評估後,再由HIRA進行評估,完成評估後給予一個臨時收載碼,最後再由MOHW決定是否收載並公告。
第三條路徑則是在朴槿惠總統任期內設立的一項政策,為針對「現行已存在的醫療科技進行再評估」(Existing health technology),目的是快速收載那些之前被排除在福利清單之外的技術。通常,這些技術因預算限制,使得技術最初被認為不適合納入覆蓋範圍,但現實仍有醫療需求。雖然韓國被認為是一個高收入國家,但其福利清單的覆蓋範圍相對較低。然而,受到這種「再評估條件性批准的技術」路徑,縮短審查時間,讓以前被排除在外的項目可以重新被納入,此也提升了韓國的健康照護覆蓋率。
第三條路徑再評估機制的作法源自於2012年設立的「參與性優先設置委員會」(Participatory Priority Setting Committee, PPSC)的成功經驗。PPSC是一個由30名公眾成員組成的委員會,這些成員會依據專家提供的訊息進行決策,成立目的是做為建議哪些醫療項目及技術應該被納入福利清單,並提出一份優先收載項目清單。2014年,PPSC調整了組織的功能,原本PPSC專注於處理和評估具體的醫療技術項目,但在2014年後,PPSC開始提供廣泛的政策指導,這些指導被整合到了韓國幾個主要機構的健康技術評估(HTA)過程中,包括HIRA、NECA和MOHW。PPSC從專注於具體技術的評估轉變為更高層次的政策制定,為這些機構的評估過程提供總體指導。韓國的PPSC也是參考英國NICE的公民會議(UK NICE Citizen Council)模式,主要也是為了實現衛生健康照護決策過程中的社會價值。為了快速將尚未納入保險的項目納入,現行第三條路徑可以不需要再經過PPSC的單獨評估流程。
韓國的醫療科技評估制度化過程借重HTA及HTR制度,PPSC的角色也強化了醫療科技再評估HTR的功能,最大的不同在於,韓國的HTR目的並不是為了想要將已收載的科技品項從福利項目清單中移除,而是在於希望可以借由HTR的功能,重新檢討那些已存在但未被納入給付的科技項目。在功能性上與其他推行HTR的國家不太一樣。HTA與HTR主要用來協助政府控制成本,而PPSC更傾向於增加成本,解決未被滿足的需求。韓國也期望可在2030年可達到將16%的GDP用在健康支出上。韓國透過NECA及HIRA加強HTA在基於證據的決策,而PPSC則增強了資源配置及社會價值的層次。
韓國基於實現全民健康覆蓋及確保衛生醫療照護資源利益公平性,學習英國NICE的作法,引入醫療科技評估的流程作為協助解決「公平性」及「預算」有限的問題6。因此,公平性分配的問題也是醫療科技評估所重視的社會價值之一。公共衛生學界對於思考優先順序的公平性,會以哈佛大學公共衛生學院的哲學系教授Norman Daniels7所提出的「說理的課責」(accountability for reasonableness)四原則:公開性(Publicity condition)、相關性(Relevance condition)、申辯性(Appeals condition)及可執行性(Enforcement condition)作為探討的框架,以確保在優先順序設定時做出理性的選擇。
儘管各國採用醫療科技評估制度的時間有所不同,但各國醫療科技評估組織在其目標及功能性上具有一些共通性的特色,如以「醫療科技評估」作為協助政策以公平分配的方式對資源進行有效的分配的想法是一致的。另外,其他的共通性特色,尚有,組成多學科團隊,包括醫療專家、經濟學家、社會學家等,以確保評估的全面性和多面性。醫療科技評估組織會強調透明度和公開性,促進公眾信任和參與,並基於證據做決策,以支持健康政策和醫療決策。此外,會持續改進評估方法和流程,以應對不斷變化的醫療技術和挑戰。
上述介紹幾個採行醫療科技評估制度的國家,並著重描述英國及韓國的作法,其用意在於解析我國健保藥品收載制度過程與醫療科技評估之間的關係。透過粗淺的簡要說明,瞭解醫療科技評估制度的功能及各國成立醫療科技評估專責單位的願景與使命。另外,2020年全球醫療科技評估政策論壇(HTAi Global Policy Forum , HTAi GPF)利用各會員投票做出的一份調查8,會員一致認同參與醫療科技評估之審議過程的核心原則(Principles for deliberative processes in HTA),在於其透明性、包容性和公正性。除了這三項被列為是重要的原則之外,其它如尊重、審查一致性及合理性,也都是重要原則。而國際的醫療科技評估組織或機構在探討醫療科技評估時,會從「審議」(Deliberative process)流程說起,因審議流程的正當性攸關資源配置的合理與公平性,甚至是醫療科技評估的基礎。將醫療科技評估作為健康照護系統工具的國家,也會參考社會價值和倫理原則的觀點,這些都是為了避免決策時可能的偏差。醫療科技評估所規範的程序包含參與權、公平、問責的權利及知情權,這些都是探討醫療科技評估時會涉及的審議原則。當然,制度在建立的過程之中會隨各國自家的情境做調整,但對醫療科技評估過程之中必須考量的「公開」、「透明」、「法規準則」及「病友(實質)參與」等審議原則的價值,皆是一致的。
肆、 我國成立獨立之專責機構的目標是什麼
臺灣在2007至2008年開始學習醫療科技評估制度9,規劃研擬初期也是參考澳、加、英三國的系統,至今所完成的醫療科技評估報告亦會參考這三個國家的評估證據。從2007至2008年間開始,醫療科技評估相關案件一直是以衛生福利計畫委託給單一單位進行評估。在制度引入時期,其所建立的方法學或評估準則亦一直延用至今。無論經歷多少次政黨輪替,醫療科技評估制度一直都沒有背離協助主管機關對衛生資源配置提供政策參考的核心目標。運作至今,較廣為人知的是應用在協助中央健康保險署(以下稱健保署)進行藥物納入給付的科學實證評估。在《中央健康保險法》的基礎之下,藥物(包含藥品、特材或醫療服務項目)若須納入健保收載給付項目之中,就必須先進行醫療科技評估。思考如何在有限的健保資源下衡量新技術納入或不納入,便會以醫療科技評估作為評估的工具。
我國既然在2007年時開始學習醫療科技評估制度,且將其應用在健保「藥物」收載等程序上,就代表它其實已經不是一個「新」的制度。過去以來,它也被運用在協助衛生福利部之各司署的公共衛生福利政策研擬之中,如飲水加氟、國血國用、LDCT肺癌篩檢政策之成本效益評估、流感疫苗成本效益評估等政策評估。不管是作為協助健保藥品收載的制度工具或是對其他衛生政策介入之資源分配,醫療科技評估早已是政策管理者在思考如何就資源配置時所仰賴的重要工具。且其在我國的發展已將近16年之久,並非是近幾年才有的制度。當前不少政策管理者對於醫療科技評估制度的陌生,以為只要找國際專家來台,講述相關經驗,就可以英國的模式刻劃出臺灣NICE的雛型。當利害關係人更進一步詢問主管機關推行的新制度如何運作,如癌症基金專款或暫時性支付制度的運作及規劃,管理者總是回應「我們已經有找英國或其他國際專家指導,舉辦研討會,學習他們的作法」,此回應顯然忽略過去16年的在地經驗與政策規劃的能力。並不是說學習國外制度是錯的,而是,在學習建構時,對於解決問題的系統性思考。醫療科技評估是一項專業的學門,若非參與健保藥品收載業務工作,相信仍有大部分人士不瞭解何謂醫療科技評估制度與健保藥品收載的關連性。此外,從各國醫療科技評估機構的發展史看來,就可理解,醫療科技評估制度的發展已有一定的成熟度。
2013年間,臺灣也曾有一次成立像英國NICE一樣的「專責獨立」機構的機會。然,受限當時的一些因素,未能實現。直至2023年底,健保署為加速藥品納入收載,提出成立臺灣專責之醫療科技評估機構的想法。在運作構想上,健保署參考英國NICE的模式,希望由專責單位負責醫療科技評估各種事務,此可與健保署內部的藥品收載業務分流,緩解內部承辦同仁的壓力。與此同時,健保署還與英國NICE簽訂合作備忘錄,希望藉由英國的經驗協助臺灣在醫療科技評估制度面上的規劃。
成立獨立之專業機構運作一直是各國在建構醫療科技評估機構時會採納的作法,不僅英國、加拿大、澳洲、德國如此,鄰近的亞洲國家如韓國、新加坡、泰國或是馬來西亞(HTAsiaLink的會員國)更是。「獨立」的專業機構之所以被賦予如此高的地位,在於其提供的「專業價值」必須受到肯定。藉由專責單位完成的實證科學評估,提供給決策者做參考,這也是國際醫療科技評估組織使命的重中之重。所謂的獨立專責,強調的是科學應建立在不被政治性價值介入的「專業性」上的獨立,而不僅只是強調在組織內部,機構的運作經費獨立。當然,專責機構最重要的另一個使命也是為制度或醫療科技評估的方法學提供專業的指引,以引導出醫療衛生資源在配置上產生最大的效益,達到全民健康覆蓋的精神。因此,成立專責單位的目的應該訴諸在「專業」的表現上,而非僅只是組織內部之經費運作或行政業務的轉移。在學術研究上,有關財團法人或行政法人的運作,最為詬病的在於其運作的監督、課責及財務的運作問題。推動法人化專責機構的過程並非僅只是將條文釋出,缺乏對專責機構所要呈現的專業架構,此外,成立前也應對未來的組織變革提供詳盡的策略方案,並與利害關係人進行充分的溝通,才有利大眾瞭解法人化後新制度或新機構所要解決的問題及運作方向10。成立專責單位的目標到底是什麼?如果是為了那些目標,也應將重點著重在目標上,提出系統性的組織運作架構。
伍、 新藥收載運作流程的治理問題
政府事務的運作,將「專業」以委託外包的型式辦理已是常態,國內對於專業委託外包的學術研究,包含行政法人或是財團法人的與政府之間的關係,也著重在「委託代理人理論(principal-agent theory)」11可能產生的「逆向選擇」與「道德危機」問題。如同,經濟學理論中「檸檬市場」12的資訊不對稱(information asymmetry)問題。具有高度專業的議題,需有某種程度的參與門檻,在專業上可能會因為不對稱的訊息,造成解讀的困難。委託單位與外包單位兩方間的互動也有可能產生逆向選擇的知情不報或報喜不報憂的管理模式。
我國一開始運用醫療科技評估是先用在協助健保藥品收載的決策考量,而藥品、特材及醫療服物項目等相關案件的醫療科技評估一直是以政府委託外包的計畫案方式,由外部單位執行。運行至今,最大的使用功能仍以協助健保署藥物收載案為主。在一代健保時期,評估單位完成的醫療科技評估報告,會提供給主管機關作為決策討論的證據。評估單位僅提供科學證據報告,但並不直接參與決策過程,雖參與專家會議,在會議討論過程中,若有需要請評估單位解釋,則由評估單位協助提供專業的意見。一代健保中藥品收載的決策會議,其運作模式或多或少沿襲國際醫療科技評估組織的作法,將「評估」(Assessment)與「評價」(Appraisal)分開。讓進行專業評估的單位負責處理科學實證的工作,不介入評價的角色。這樣的運作模式或多或少保留了專業單位僅需要對專業負責的作法。
自2013年二代健保推行以來,《中央健康保險法》規定,藥物在納入收載前須進行「醫療科技評估」。此外,藥物給付標準及支付項目必須由保險人與相關機關、專家學者、被保險人、雇主及保險醫事服務提供者等代表共同擬訂,並邀請藥物提供者及相關專家、病友等團體代表表達意見,即「全民健康保險藥物給付項目及支付標準共同擬訂會議」(共同擬訂會議)。共同擬訂的概念來自於「審議式民主」理論。審議一詞在理論上具有公平、公開、合理、可溝通、涵容等意涵。政策執行過程中的公共參與、公平審議及在充分的資訊基礎上做出判斷,這些都是審議式民主理論所提倡的價值。
在一代健保時期,健保藥物收載的決策程序主要由主管機關聘請專業專家進行討論,會議過程並不公開。二代健保修法以後,在《中央健康保險法》的架構下,藥物收載過程須執行醫療科技評估,完成評估後須經共同擬訂會議,因此,共同擬訂會議為最終的決策會議。雖如此,主管機關,也仍繼續採行一代健保時期的「專家會議」(當時稱為藥事小組會議),以此作為專業討論的必要。從二代健保後,藥物收載的決策過程就衍生出兩階段會議的型式。過去以來我們並沒有把這兩階段會議產生的問題說明清楚,導致在流程上面有各種不同立場的自我解讀現象。至今,對於藥品的收載或給付規定的問題,仍有利害關係人無法理解「決策」是誰做的。以當前的運作模式來說,專業的決議其實是在專家會議形成的。共同擬訂會議存在的問題大多是「健保總額」的財務問題。在共同擬訂會議過程中,其所參考的會議資料,在某種程度上來說,是已經把「專業」定型好的意見。只是,對於這些專業,會不會有疏漏或資訊不對稱的問題,則另當別論。因此,當討論到何以新藥收載流程繁瑣且耗時,就必須理解現實脈絡的運作狀況,才能確切的在問題根源上尋找治理的解方。
要在這兩階段會議中(專家會議與共同擬訂會議),思考如何加速新藥收載,解決可近性的問題,就必須理解這兩階段各自存在問題。這些問題並非是推動「平行送審」就可以解決的。因為平行送審是藥證取得與健保同時審議的「時間」問題,能否直接對應到健保收載的流程問題,此應該是兩個不同的議題。畢竟,健保觀點所考量的情境與藥證觀點不同。推行平行送審嘉惠何種時間的速度,也可以用日後實際運作的狀況,由主管機關提供「實證的數據」向大眾說明是否真的有加速新藥的收載,以實證數字說明政策推行的效益。本文提出此兩階段的流程的問題,目的是提醒管理者,這兩個會議存在的問題若沒有適當的解決,僅只是造成各利害關係人在各自的觀點裡論戰,對加速新藥收載的成效有限,且對現行健保治理的運作存有各自解讀的偏見,也易造成因行政效能不佳,打擊處理公共事務同仁的努力。當前的問題根源是什麼,未來應如何優化,只有確切思考並面對才是關鍵因素。
一、 平行送審機制可以加速新藥收載嗎
2023年底,健保署宣稱平行送審機制,可縮短健保收載生效給付的審查流程,等於在申請藥證的階段中,廠商可以同時申請納入健保,並認為此舉可縮短時程,加速至10個月內就可以獲得健保生效給付。在推行這個政策的同時,管理者並沒有交代兩端平行送審時可能會遇到什麼不確定性的因素,如,倘若平行送審案,一路順利獲得健保藥品專家會議的決定,在最後進入共同擬訂會議的這個門檻時,必須等藥物許可證審查底定,獲得食品藥物管理署之藥證,才有可能提入共同擬訂會中,否則,就算健保端的醫療科技評估審查及專家會議都審查完成,也沒有辦法進入共同擬訂會議中,沒有共同擬訂會議,就沒有收載生效的可能。而藥物能否取得許可證,有其審查專業的考量,藥證審查與納入健保收載的審查,兩端各有不同的專業考量及評估觀點,其考量科學實證的立場也不同,有無可能,兩端的主管機關,日後在加速新藥的可近性問題上面臨非專業性的壓力?
在嘉惠新藥的可近性上,有無可能健保主管機關可先針對那些已取得藥證,但礙於財源不足而被迫放棄納入健保給付的藥品做加速收載的可能?那些已取得藥證,且臨床療效證據也充分,但礙於財務因素,而無法被納入健保,那樣的品項是否才是健保最該力排眾議去爭取加速納入的產品?2023年拋出的平行送審,在制度面上滿足了藥證與健保證同時審查,但在實質面向上,對加速新藥及時程可能幫助有限。管理者應可盤點過去已取得藥證,但在財務因素上無法納入給付的品項,不管是新藥或是擴增適應症之品項,相信仍有產品是被排除在健保給付清單中的。
過去幾年來,曾有不少專家以自己觀點提出建議,認為當前的藥證審查與健保審查,同樣都是由同一個單位(財團法人機構)負責,他們應該可以結合兩端的審查資料,同步受理,加速審查。提出此建議,固然可緩解疊床架屋體制下的不便性,但卻缺乏了對我國公共行政管理組織運作的認識。因為,在依法行政的課責下,管理機關必須依照法源規則處理業務。政府部門內不同的主管機關,其運作也存在著兩管理端之間的「跨域管理」問題。當然,在藥品政策上能否與時俱進,同步思考以節省行政效能是好事,但,被委託的財團法人單位能否有足夠的法源行事,也待兩主管機關或更高的行政體系的協調。管理單位若沒有想要在主管機關之間內部進行溝通與協調,此建議永遠淪為空談。
或許,健保新藥收載的問題從來就不是天數問題,而是在健保新藥新科技預算不足的問題。著重在平行送審機制,是否只是行政官僚體系中較好掌握的一項優化議題?加上,政策管理者有獲得民眾好感度的壓力,轉移實際運作的問題,也是一種管理上的解套。然而,健保新藥可近性的問題,也從來都不是只看表面數字700多天的問題,而是健保財務預算的問題。
二、 審查過程真的慢嗎
自開始採用醫療科技評估制度之後,一件藥品的評估案就被界定在42個日曆天內完成一份醫療科技評估報告,意即,從委託單位接收到健保署委託的公文後就開始列入評估案的第一天(2023年以前的運作是由健保署發函委託單位,2024年平行送審推行後,則由廠商自行送件至主管機關及被委託單位)。過去以來,各界探討所謂的審查時間界於700-728天這類的數字13是指,從送件後到歷經至『全民健康保險藥物給付項目及支付標準共同擬訂會議』做出決策的時間,所以評估報告完成的時間只是這個案件生命歷程的一小部分。過去以來,不少人認為醫療科技評估的完成時間太慢,導致收載的速度緩慢,其思維應該可以做些調整。因為,在現行42天完成評估的嚴格時程管控之下,一件評估案件大都是在42-60天內完成(有些特例則視案件的屬性與主管單位協調完成時間)。一般案件不至於在審查報告過程中延宕太多。如果將整個審查流程攤開逐一檢視,應可理解,完成醫療科技評估報告後,在進入藥品專家諮詢會議的階段,往往會因為一件藥品的預算估計方式不同(醫療科技評估中有所謂的PICOS框架,這些設定會影響藥品財務的推估),因此在財務的預算上就有不同的數字,這些數字會影響健保收載後對整體健保資源預算的影響,因此,在專家會議的階段中,必須經歷數次的討論。等有其較確切的結果後,才會進入共擬會議階段。早期,一件健保案僅有一次提專家會議的機會,後期,主管機關在管理上採取「較寬鬆的溝通」型式,逐步導入所謂的「廠商可針對醫療科技評估提出回應意見」、「面對面溝通」及「兩次提專家會議」的機會。上述這些過程往往需要經歷多次的討論,所需要運作的行政時間及成本高,且都不是外人可輕易窺見的資訊。因此,對於所謂的審查時間,應該實事求是,分辨到底是什麼問題引起的,再提出解決方案。「時間」當然是產業界在意及關心的焦點,但是管理者應該先回到整個流程的架構中做思考,重新檢視看看哪個環節造成的問題。
三、 藥品專家諮詢會議的運作現況
行政主管機關聘請相關專家就專業議題進行討論或召開會議,這是機關內的「專業諮詢」的行政權力。在不同專業領域上也有案例可循。過去有學者研究,具有科技風險的決策,必須仰賴具有實證為基礎的專家協助14,如類似環評制度的專家會議。因此藉由專家代為協助處理專業也是機關內部的常態。雖然機關有此「議程設定」的權力,但高度專業的科學醫療問題,與公眾息息相關,當管理者未能在制度上提出更具說服力及透明的公開資訊,就會造成公眾與專家間的認知鴻溝。產生公眾或利害關係人可能對專家的不信任感,加上管理者又未能提出解決政策風險問題的溝通機制,以至於存在多年的專家會議(雖然前身是藥事小組會議),也未能縮小其決策造成的不信任感。加上,專家制度的成員組成問題,存在著代表性的問題,誰可參與?參與的標準是什麼,一直未有公開透明的規則。本文將就專家會議運作的狀況與問題進行簡要的梳理,以利瞭解健保藥品收載過程何須就問題的根源進行對治。
- 專家的遴選標準是什麼
我國的健保藥品收載制度,極度仰賴國內的各專科醫學會之專業意見,健保治理中的專業專家也多來自各專科醫學會的代表,但並非每個專科醫學會瞭解專家的遴選規則。不同專業領域的代表成員何其多,如何被選入參與專家會議,目前在制度上並沒有公開的作業說明。因此,所謂的專家會議之初核決議,其所作的決定既為專業的決定。那麼這些專業的專家是誰?參與者的遴選標準,就應該也有詳盡的公開規則。專家會議的階段會決定一件藥品案件能否順利走到共同擬訂會議的階段,被聘任的專家成員又多為不公開,在理性選擇理論的世界裡,委託與代理人之間必然存有道德危機與逆向選擇的問題?除了參與者的代表性外,有無可能專家的社會階層背景有一定地位,導致沒有人,或有能力質疑做決策的成員。更甚者,有無因為專家是主管機關所偏好的,是社會地位名聲顯著的參與者,因此當決策可能有瑕疵時,無人敢提出質疑。因此,公開決策專家的參與標準,保障其決策的品質是公共治理的基本態度。學者Arnwine曾提出醫療事務組織的運作是一項團隊運動,不管是醫療從業人員、管理層還是委員會成員,團隊中所有的成員都必須瞭解治理的角色以及什麼是有效的治理15。對於參與委員會的委員特質,他也提到必須著重在知識、技能、態度與個人特質三個層面。在知識層面上,委員會的成員是否瞭解組織的任務及價值,對健康經濟的計畫及財務預算的狀況還有當前組織的財務定位。對於治理及管理的差異有無足夠的認識。此外,專業的技能包括有無瞭解運作的財務規劃的能力,在其所參與的醫療領域中是否有經驗,能否以建設性的方式處理不同群體的想法等,這些都是參與專家會議可參考的遴選指標。而當前的專家會議治理決策模式,無人可窺見。而利害關係人在自由市場競爭的壓力之下,必須透過看不見的手窺探決策結果,其反而有害會議的運作,不利治理。 - 專家的專業與權力不對稱問題
專家的專業程度也會影響決策的品質。以歐洲病人治療創新學院(EUPATI) 在其醫療科技評估系統課程介紹中提出的觀點為例,一項產品,在藥證法規單位及醫療科技評估單位兩方所要評估考量的觀點是不同的。如探討Efficacy(功效、效能)及Effectiveness(效用/有效性),在藥證與醫療科技評估之間的審查觀點是不一樣的。參與健保決策的專家對醫療科技評估的範疇是否有基本的專業概念?另外,世界衛生組織WHO也曾就社會參與過程中,所謂參與者的代表性提出相關的見解,如,在健康政策的決策過程中,是否可以擺脫權力不平等帶來的差異,權力的不平等有可能存在於公眾的社經地位、政府對議程設定的掌控中。當我們在討論科學決策的同時,往往忽略了在科學決策中存有的一定風險,即這些科學決策的論辯可能受限於時程、資金、範疇界定及資訊不足等因素,因此只能在有限的時間下產出有限的知識供作決策的參考。掌握論述的一方(權力較高者)往往主導了科學知識的生產;詮釋與解讀,也影響並管制政策的走向。在藥品收載案的科學討論中,對其財務的「不確定性」與「未知」,或許也常成為藥品政策不作為的最佳藉口16。 - 以委託外包方式辦理專家會議適切嗎(缺乏對外界的理解)
2024年平行送審制度推行後,健保署一併將「專家會議」(初步的決策會議),以委託案方式同步委託給外包單位執行,此舉擴增了過往醫療科技評估(HTA)只負責評估的角色與功能。也讓醫療科技評估的「評估」與「評價」角色更為混淆。原本只負責評估案的被委託單位,也需負責辦理專家會議。而受委託單位僅只是換湯不換藥,將辦理專家會議的時間從原本維持在健保署召開的(通常是9點半至2點前)改成在外包單位內部召開,會議分成上、下午兩場,並以案件類別(癌藥或非癌藥)舉行。但有關專家會議的流程、參與者遴選標準、參與者代表性等皆未有詳細的公開。專家會議辦理的型式大致上皆沿襲以往的運作模式,且仍無有較公開透明的資訊呈現,外人則永遠對健保收載決策充滿不信任感。
轉由外包單位辦理專家會議,主管機關認為這是「行政事務」的委託外包。參與專家會議的組成成員仍由主管機關決定,主管機關稱此為低度的公權力授權,但最後決定權仍為主管機關。外包的「行政事務」其範疇意指:案件收案之相關查核事務、執行HTA評估、發函完成後的評估報告、辦理專家會議(涵蓋邀請參與會議的專家出席、廠商申請到會報告事宜、撰寫專家會議紀錄等)。主管機關認為共同擬訂會議是法定的決策會議,所以藥品收載與否,仍以共同擬訂會議作出的決定為主。因此,共同擬訂會議的相關事務由健保署負責執行,此舉代表其權力仍在官方手上,不會有公權力界定不明的問題。主管機關認為行政事務的外包有助於健保署處理後續共同擬訂會議及繁瑣的藥品給付協簽署業務(MEA或PVA)。
然而,處理委託與被委託之間,尤以在授權的層面上,若沒有清楚的界限,易讓外界產生混淆。過往,主管機關的執行人員可以明確的在一件事上做出較清楚的對外回應,但當業務轉向以由被委託單位的人員執行,其在對外回應上可能有無法拿捏的狀況。在過去一年來,曾有產業界表達,當要詢問有關行政收載流程之間的問題時,找不到可以確實回應問題的承辦人。向主管機關詢問,僅表示現行收載流程皆由委託單位負責,應該與委託單位聯絡;但當尋求委託單位時,卻又無法就問題給予立即性的回應。此舉忽略了在運作過程中利害關係人的意見回饋及委託單位與外包單位兩方之間的責任模糊化問題17。此外,學者Steven Rathgeb Smith和Michael Lipsky18,在其《雇用非營利組織》一書中探討到非營利組織必須仰賴政府的預算,在某種程度上可能必須遷就政府所施加的要求,因此在專業性上可能無法兼顧其專業自主性。 - 專家會議何以耗時?能充分討論?
專家會議的審查重點在於臨床、財務及給付規定訂定的觀點。一件新藥案,並非在第一次專家會議後就可以立即做出決定。二代健保剛推行時,當時的確是僅有一次提專家會議討論的機會。然,一件新藥案,廠商送件時的財務觀點,到完成評估報告後,其財務觀點可能已經變異,不管如何,僅有一次進專家會議討論的機會,無法真實的反應評估過程中到底是以何數字做出的基礎。因此,一件健保申請案,提入專家會議討論的機會就由原本的一次調整為兩次。專家會議除了就臨床證據進行討論之外,最重要的部分是在財務基礎下訂出一個健保可接受的財務範圍。這個過程必然「繁瑣」,甚至,一旦健保議案多,一件案件可討論的時間僅有10至15分鐘。這也是這個會議流程的先天性困境。健保署約莫在2015至2016年間調整「專家會議有兩次提會的機會」,因此,一件新藥案,在這兩次討論的機會之中,廠商也有重提一次申覆的機會,此時若重新調整方案(不管是臨床證據或財務方案)都需要再委託評估單位再重新評估一次,這些一來一往的過程,勢必就會延長審查的時間。這是當前制度不可忽略的問題,即便推出平行送審新制,在專家會議的審查流程上,並沒有真正達到緩解或加速的可能。這個問題是管理者必須思考的系統性問題。而非隔空把脈,認為在藥證審查時同步受理健保案就可加速收載。
藥品能否納入給付的觀點除了考量實證證據之外,也需有藥物經濟學19的觀點,參與藥品專家諮詢會議的專家群,至少在這樣的框架之下做決策;然而,受限於「健保財務不足」的因素之下,做決策時可能得在某種情況之下對藥品做出給付規定的限縮。這是藥品收載的考量的決策情境,因此,受聘的專家,在某種程度上,可能無法可以有所謂的專業自由論述空間。專家會議必須在主管機關所賦予的使命之下,考量健保的整體財務問題,因此,只要這個「健保財務考量」的先天性因素不能拋棄,就有可能必須在一來一往的財務協商過程中做多次的討論。在無形之中,商業談判的模式變成一來一往的紙上談兵,而每一次的價格計算往來就需要時間的累積(重送財務評估方案再由被委託單位重新評估的時間成本)。
此外,出席會議的專家若非長期擔任,可能也無法有足夠的資訊瞭解健保藥品收載的運作狀況與管理規則。這種現象也會發生在新聘任專家參與會議時,如在核價討論時詢問證據的立場、核價計算原則等執行面與管理面的細節。
在不須負擔任何健保治理效能的問題,健保政策的專業治理,顯然還有進步的空間。我們如何在一件「領出席費」的議案上為健保政策做良善且有系統的專業建議?這些必然也是需要管理者重新思考的問題之一。
四、 盤點癌症藥品給付項目,全面接軌國際治療指引
在「健康臺灣」的政策催促之下,政府誓言要在2030年將癌症死亡率降低三分之一,然而,要達到這個政策目標,首要面對的問題就是加速新藥納入健保給付,讓臨床端有足夠的新藥可以使用,增加治療的選擇。除了積極盤點現行各大癌藥治療缺口之外,也須比照「美國國家癌症資訊網」(National Comprehensive Cancer Network, NCCN)治療指引的作法,將建議優先使用的藥品儘速納入健保給付。
2024年12月病友領袖學院舉辦一場「年終健保給付政策檢視圓桌會議」,該場會議邀請數位癌症專科醫師,針對第一線臨床治療現況及現行給付藥品進行說明,涵蓋泌尿道癌、腎臟癌、攝護腺癌、上皮細胞癌、胃癌、肺癌、肝癌、等多種癌症藥物。幾位專家肯定主管機關在癌症治療政策上的努力,但也指出,癌症治療的變化已經超越了現行健保給付藥品,無法滿足實際臨床的需求;雖然隨著新科技的開發,病人存活期有顯著的提升,但受限於給付的門檻,形成病人看得到但卻用不到的窘況。
現行的癌症治療,受限健保的給付狀況,較新型藥物或是突破性的創新治療並不能納入健保給付。主管機關也因為健保預算有限的問題,在藥品收載的管控上,僅能選舉最有效、風險較小的病人族群,因此,找出高風險的病人並給予治療,是臺灣未能跟上國際潮流的因素。以膽道癌為例,現行治療仍以化療為主,仍有很多藥品無法獲得給付。綜合該場會議幾位專科醫師對於現行給付癌藥的建議,本文整理之結論如下,或許,可作為參考意見。
- 建議健保給付項目應以科學實證為主,財務衝擊為輔。且健保給付決策過程應該公開透明,以受公評。
- 主關機關應主動定期檢討給付規定條文,而非被動調整。雖然給付「建議」案需由廠商主動提出,但主管機關有行政的優勢,或許可在修定給付條文上,採取主動出擊的策略。
- 可試著在現階段盤點癌症藥品給付順序時,適度納入病友的意見,逐步調整參與之機會。
- 現行的共同擬訂會議紀錄及錄音檔雖然都有公開上網,但無法透過紀錄瞭解給付規定修正的脈絡。也不易讓沒有參與過程的專家搜索,建議公開資料的品質應該有所優化。
- 推行百億癌藥基金與暫時性支付制度,納入此制度被收載的藥品,必須提供收載2年內的真實世界資料(Real Word Evidence , RWE),而RWE的執行應該由專業的學術單位來做,畢竟檢視資料的相關指標,需具有專業的臨床經驗,這並非是委託某一單位就可以判斷的。建議在專業程度上,應該與更多專門的學術或更具經驗的臨床專家執行。
- 臺灣應該發展建立自己的RWE中心,蒐集臺灣的資料。因國際藥廠礙於藥品的市場策略,有些藥物的後續追蹤並沒有再繼續執行,藥廠不執行,就不可能會有RWE的資料,即便制度設計要求廠商必須提交2年後的資料,也不可能有廠商提供的出來。對於現實面的國際觀點,也應一併思考,才能在政策推行時,訂出有效的管理策略。RWE資料未來的應用,應該由主管機關自己執行與規劃。而RWE資料的蒐集必須透過與學會及病友團體的合作,納入病友的聲音,此亦是補足第三期臨床試驗沒做的證據。
- 現行的專家會議制度,專家是誰?參與成員的機制是什麼,是否有遵守利益迴避的原則,有無公開徵選或公布?對於專家會議的機制,建議應可再透明。
五、 暫時性支付政策的目標
暫時性支付的政策目標是爲了讓一些情境較不確定的新藥可以在某種程度上,有一條路快一點納入健保給付的路徑。利害關係人對於暫時性支付制度的存在也存有某種程度的期待,而這種期待也是政策管理者想要解決「新藥可近性」的問題。應對這個政策的「目的」提出合宜的收載流程機制。2024年,健保署約有24.299億元的「暫時性支付」預算使用,執行一年的狀況及經費使用率,應可借由2024年之實際運作經驗,提出實證管理數據,作為日後的管理參考。倘若,執行率偏低,在有預算的狀況下仍然無法將預算使用完畢,代表過去這一年的流程及管理,可能還有可改變及優化之處。而2024年底,健保署提出的「癌症新藥暫時性支付專款作業原則(草案)」,在申請流程的程序上,看起來是多了幾道審查的關卡,因作業原則中,仍需要求廠商必須提供一定程度的資料進行審核,審核後才能作出決策。是否真的可以達到加速收載納入暫時性預算之中,也有待商榷。推行暫時性支付政策,如果目標是嘉惠利害關係人,包含病患可快速接受新藥,降低疾病風險,或減少癌症死亡率,那麼,設計流程時就必須更具系統性及人性化的思考。另外,冗長的行政管理也需要耗用行政成本,這些無形之中也是一種支出,建議,暫時性的機制設計,應該可以拋去主管機關的主觀立場優勢的心態,以利害關係人角度之觀點為出發點,才能更符合管理及政策目標。加上,目前提出的「草案」,其流程與作法也是模擬國外的經驗,其計畫書中所需提交的相關證據與資訊,是否有逐欄與國內臨床專家進行討論,缺乏國內本土臨床醫師的建議,計畫書是否無法再與後續的資料蒐集產生連結?這都是面對數位化時代時,應一起一併思考的系統化管理問題。不建議以國外的範本,翻譯成國字後推出實行。對於暫時性支付的流程設計,及所需要產業界提供的資訊,應有專業對話的空間。
六、 共同擬訂的審議參與有辦法取得有共識的價值?
我國的健保總額制度採支出上限(浮動點值)的設計,當實際總服務量大於原先協議的總服務量時,每點支付金額將降低。因此,不同的利害關係人,對於藥品是否收載,當然有不同的價值考量。共同擬訂既然遵行審議式民主的精神,必然有不同利害關係人的參與,滿足「參與者的多元」。在理論的世界裡,建立「共識」雖然是解方,但真實世界的運作存有價值差異的問題。民主自由平等的價值,顯然沒有教會我們要如何處理「理性選擇」的競逐問題。學者Arrow提出的「不可能定理」(Arrow’s impossibility theorem)反應在共同擬訂會議的制度上,「想要把個人偏好集體組合成集體偏好,同時要求『集體選擇理性』與『程序正義』的決策程序,是不可能存在的。」我們希望擁有自由民主的權利,但對於民主的價值卻又如此陌生,各界至今仍存有「怎麼會設計出這種共同擬訂的會議型式來做健保的決策」,其實是輕看了民主的精神。共同審議的價值美好,本身並沒有錯誤,而是制度設計與人性的問題。因為經濟市場競逐的藥品收載問題,存有不同的思考價值。民主顯然並沒有錯,而是我們必須在經濟市場中討論出一個具有共識的決策,而共識需要時間的累積。現行的共同擬訂會議運作顯然沒有充沛的時間讓參與者進行溝通與對話,消弭彼此不對稱的觀點。而溝通與對話都需要行政運作的成本,在追求民眾高滿意度的狀況下,就不會是主管單位會採納的因素。
陸、 建議與結論
健保改革議題接連拋出,突顯健保財務資源的緊迫性。醫療科技評估與健保財務資源的合理分配和永續發展息息相關,如何在增長的臨床需求、藥品與治療技術創新中提出前瞻性政策,是當前的挑戰。健保制度範圍廣、影響層面大,改革時不能忽略其他系統性問題。無論變革內容是什麼,必須理解「健保財務」是影響健保收載速度或新藥可及性的關鍵因素。政策方案需具備長遠執行力,以確保政策能夠延續。
在執行健保事務的人員應擁有一定的專業程度,內部組織管理問題應系統性解決,而非將問題簡單歸咎於「人力不足」,或轉移到其他組織。將未解決的人力問題轉至外包或專責單位只會延續行政管理效能的問題,且可能忽視應在專業上提供政策建言的角色。新改革措施雖然表面上緩解了公務機關內部組織管理及人力問題,但實際運作可能對健保長期運作產生影響,加重行政成本。管理者需審慎考量相關運作及規劃,健保治理的專業性隨著人員更替而變化,政策管理者需要具備應對快速變遷的能力。
此外,改革過程中,必須綜合考量行政效能與成本,避免過度追求短期內的成效,而忽視長期健保政策專業性或系統穩定性。面對組織管理問題,應全盤考量是否委託外包或成立專責單位。處理這些問題時,全面性解決方案是避免長遠運作受到影響的關鍵。確保政策在健保體系內的穩定推進,需要靈活應變、專業管理及持續的資源投入。
有關平行送審或加速審查的議題,在制度設計上或許可以參考韓國的作法。韓國早在2014年8月就已設立一站式審查系統(New Health Technology Assessment One-Stop Service System)20,對於新科技技術的許可證及健保申請之相關的行政、審查與評估程序集中在一個平台上,讓審查部門的MFDS、及HIRA及NECA可以同時在系統上進行審查,簡化流程,提高效率。2014年10月推行有條件的暫時支付(Implementation of Conditional Approval for Evidence Development),對於臨床試驗尚未完成,基於那些僅有初步或早期數據尚在進行中的產品予以收載,此暫時性支付的意涵與我國目前所要推行的暫時性支付概念相似。這類產品通常會再要求廠商附加後期的證據。
此外,為解決社會對於「將嚴重疾病新藥快速納入健保給付」的迫切需求,2023年韓國MOHW公告「生物健康新產業監管創新方案」21,對於加速新藥收載部分,提出「改善新藥快速登錄制度」(신약 신속등재제도 개선),在MFDS許可證完成前,只要安全性及有效性審查完成,即可同步進行健保給付審查,將過去分階段審查調整成同步執行(如下圖) 。此調整可讓健保審查及後續的議價程序加快由原本的210天,減至150天。韓國的加速審查機制,著重在HTA評估與議價階段的時間。目前我國的HTA審查與議價階段,可視為是健保署的職掌範圍,因此,加速平行審查制度,或許可參考韓國的作法,將議價審的階段提早在HTA評估時期就介入,提早啟動這段時間的「平行」,如此才可在不涉及前端的藥證主管機關的業務內加速時程,此舉或許是單一主管機關可掌握自己業務裁量權的作法。當然,我們肯定當前推出的平行送審制度,代表主管機關至少在某種程度內有思考平行審查的重要。韓國早在2014年就已啟動主管機關在同一個審查系統內進行審閱,雖文獻中無法得知運作的細節,但,在十年前,平行審查的概念也早就引入運用在審查平台的運作上。
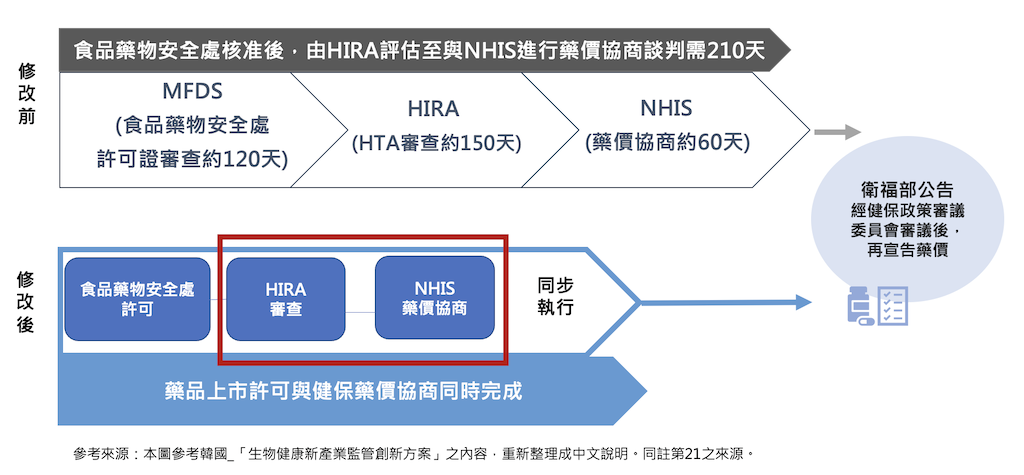
另外,不少病友團體對於想在醫療科技評估審查階段時就提供相關意見供主管機關參考,此亦可參考前述提到的PPSC的經驗,借用PPSC的模式,主動選擇在某些小型的研究案議題,讓病友有機會參與。而現行正在進行的相關癌症藥品給付與國際接軌一題,或許就可以作為一種政策預評估。健保受限於財務的現實層面,決策必須科學與理性,但執行公共政策的人若能在作法上釋出軟性溝通機會,也不失為在病友參與政策上為民謀福利。
邁入2025年,健保改革勢在必行。醫療科技的快速發展,無論是新藥物、創新醫材還是智慧醫療技術,都為健康照護帶來全新的可能性,同時也對健保財政穩定與資源分配公平性形成巨大挑戰。在改革過程中,醫療科技評估(HTA)扮演關鍵角色,不僅評估新技術引入後的相對療效及財務成本效益,更是確保健保資源有效利用的重要工具。近期推動的各項健保新藥措施,對未來健保總額財務的運用也具有牽動性的影響。健保收載政策是長遠的政策執行問題,政策的推行不能僅限於短暫的二至三年,而應著眼於長期持續的發展,確保政策的延續性與穩定性。而專業的健保政策也應該避免政治性的因素,不宜受首長任期時間的轉換而影響,推出只能執行一至兩年的政策,當首長轉換後又重新調整政策。健保藥品收載制度的改革關鍵在於如何平衡當前需求與未來發展,並確保制度的長期穩定與公平性。我們建議主管機關在制定新政策時,應綜合考量上述層面,避免過度追求短期內的民眾好感度或成果,而忽視長期健保政策的專業性與系統運作的穩定性。唯有如此,才能在變局中為健保制度奠下穩固的基石,讓每位民眾均能享有公平與持續的健康照護服務,實現健保永續的理念。
參考資料
註1:相關健保改革政策,參考健保署長於2023生醫領航產業交流會之對外簡報。
註2:健保署推動加速新藥收載制度時,對外宣稱僅有8位人員可執行健保藥品收載業務,因承辦人員業務量大,必須成立專責醫療科技評估辦公室。參考來源與註1同。
註3:英國國家健康暨照護卓越研究院(2020),〈健康平等評論NICE AND THE MARMOT REVIEW〉,HTTPS://WWW.NICE.ORG.UK/ABOUT/WHAT-WE-DO/NICE-AND-HEALTH-INEQUALITIES
註4:Walley T. “Health technology assessment in England: assessment and appraisal”. Med J Aust. 2007 Sep 3;187(5):283-5. doi: 10.5694/j.1326-5377.2007.tb01244.x. PMID: 17767433.
註5:有關韓國醫療科技評估制度可參考:Oh J, Kim MJ, Hur S, Oh J, Kim DS. Institutionalizing Health Technology Assessment and Priority Setting in South Korea’s Universal Health Coverage Journey. Health Syst Reform. 2023 Dec 31;9(3):2338308. doi: 10.1080/23288604.2024.2338308. Epub 2024 May 7. PMID: 38715186.
註6:同註5。
註7:Daniels N. Accountability for reasonableness. BMJ. 2000 Nov 25;321(7272):1300-1. doi: 10.1136/bmj.321.7272.1300. PMID: 11090498; PMCID: PMC1119050.
註8:Bond K, Stiffell R, Ollendorf DA. Principles for deliberative processes in health technology assessment. International Journal of Technology Assessment in Health Care. 2020;36(4):445-452. doi:10.1017/S0266462320000550
註9:可參考健康效果暨醫療科技教育聯盟之「臺灣醫療科技評估制度的創建之路與歷程回顧」。
註10:朱宗慶(2009)。行政法人運作的再思考。研考雙月刊,33(3),22-31。https://doi.org/10.6978/YKSYK.200906.0022
註11:莊文忠、徐明莉,2019 委託代理人理論與第三方評估機制之建構:以政府捐助財團法人為例。
註12:Akerlof, G. A. (1970). The Market for “Lemons”: Quality Uncertainty and the Market Mechanism. The Quarterly Journal of Economics, 84(3), 488–500. https://doi.org/10.2307/1879431 1970年,經濟學家George Akerlof發表了一篇名為「檸檬市場:品質不確定性與市場機制」(The Market for Lemons: Quality Uncertainty and the Market Mechanism)的論文。檸檬市場表明,在賣方比買方瞭解更多資訊的市場中,存在資訊不對稱(information asymmetry)問題。由於賣方怕不能以應有的價格出售,買方怕買到隱藏瑕疵的商品而殺價,最終將導致交易乾涸。
註13:參考公視新聞網_(2023.12.4)抗癌藥昂貴苦等新藥審查通過 病友團體籲審議時程透明化。https://news.pts.org.tw/article/669712
註14:周桂田(2004)。獨大的科學理性與隱沒(默)的社會理性之“對話”-在地公眾、科學專家與國家的風險文化探討。台灣社會研究季刊,(56),1-63。https://doi.org/10.29816/TARQSS.200412.0001
杜文苓(2012)。環評制度中的專家會議-被框架的專家理性。臺灣民主季刊,9(3),119-155。https://doi.org/10.6448/TDQ.201209.0119
註15:Arnwine DL. Effective governance: the roles and responsibilities of board members. Proc (Bayl Univ Med Cent). 2002 Jan;15(1):19-22. doi: 10.1080/08998280.2002.11927809. PMID: 16333402; PMCID: PMC1276331.
註16:杜文苓(2011)。環境風險與科技決策:檢視中科四期環評爭議。東吳政治學報,29(2),57-110。https://doi.org/10.6418/SJPS.201106.0057
註17:丘昌泰2000 《公共管理—理論與實務手冊》,台北市:元照出版社。
註18:Smith, S. R., & M. Lipsky (1993). Nonprofits for Hire: The Welfare State in the Age of Contracting. Cambridge, Massachusetts: Harvard University Press.
註19:本文所稱藥物經濟學旨在強調參與專家的專業領域。
註20:韓國HTA設置過程或機制https://nhta.neca.re.kr/nhta/publication/nhtaU0605L.ecg _New Health Technology Assessment System of South Korea
註21:韓國_ 生物健康新產業監管創新方案,取自Federation of Middle Market Enterprises of Korea (FOMEK)網站https://www.fomek.or.kr/main/policy/law/policy_view.php?wr_id=801&fbclid=IwY2xjawHq_UdleHRuA2FlbQIxMAABHUUlT47fDx2T2l-7dfq2Zf0DULlsMHUg44Kb3af1y5Hu5AkI7FWOnL9agw_aem_CCgrATDqOwaJeil-x9x1pg
註22:本圖參考韓國「生物健康新產業監管創新方案」重新整理。同註21。

