健康效果暨醫療科技教育聯盟秘書長 楊雯雯
有感各界在討論「新藥建議全民健康保險收載」議題時,偶有發生彼此以為論述同一件事,實則各說各話的窘境,故而嘗試以食品藥物管理署、國民健康署及中央健康保險署公開資料製作現階段「新藥(罕藥)建議全民健康保險收載作業流程」圖表,以利在探究及議論相關內容時,對彼此論點涉及哪些流程位點及利害關係者能有較清楚的理解,避免誤解。
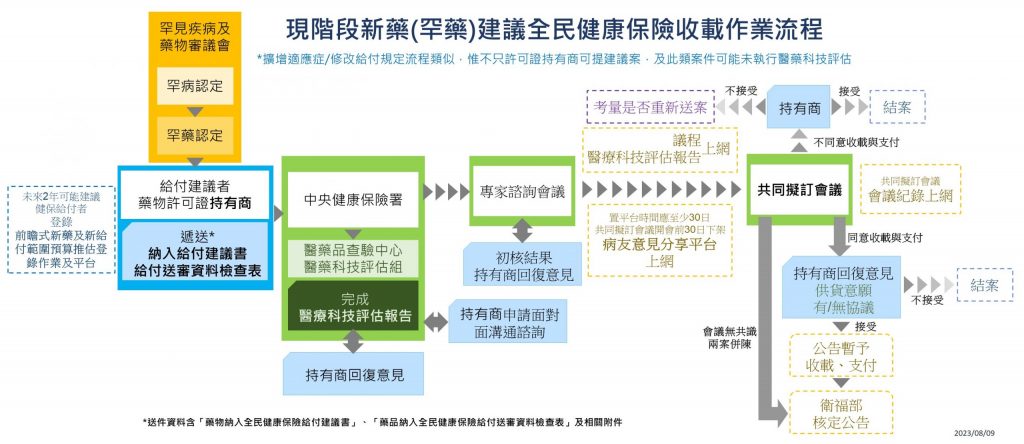
圖一為簡易流程圖,從藥物許可證持有商在取得食品藥物管理署之核准函(approval letter)或藥物許可證後遞送「藥物納入全民健康保險給付建議書」、「藥品納入全民健康保險給付送審資料檢查表」及相關附件至中央健康保險署起,至中央健康保險署得委託醫藥品查驗中心醫藥科技評估組執行醫療科技評估,至中央健康保險署辦理「專家諮詢會議」,及得依「全民健康保險促進病友參與藥物納入健保給付決策作業要點」將重大傷病用藥上架「病友意見分享平台」收集病友意見,接續辦理兩個月一次的「全民健康保險藥物給付項目及支付標準共同擬訂會議」,最終視會議決議辦理可能之議價協議、回復持有商及結案等事項。新藥若為罕見疾病用藥,則需先經「罕見疾病及藥物審議會」辦理之罕病認定及罕藥認定的橘黃色區塊,或是依「藥事法」及食品藥物管理署主責之新藥查驗登記審查機制辦理罕藥查驗登記(非罕藥則無橘黃色區塊步驟,但需經查驗登記)。此外「前瞻式新藥及新給付範圍預算推估登錄作業及平台」係中央健康保險署為推估新藥及給付規定範圍改變所需之年度預算編列所建置之系統,已自2020年9月起運作,由各藥物許可證持有商按其要求登錄相關資訊及數據。
(註:點擊圖片可放大)
圖二除作業流程外,另依各相關利害關係者,分解其可能涉及之活動。藍色方框內為所有「新藥建議全民健康保險收載作業」。橘黃色方框內同上,主要針對罕見疾病用藥作圖;若為非罕見疾病用藥,亦同上,需經查驗登記。

(註:點擊圖片可放大)
圖一及圖二係融合公開資訊所繪製,部分內容恐因缺乏官署運作之內部資訊而不夠完整,歡迎提供修正建議。此外,感謝本會會員在繪製時提供寶貴意見,讓內容更為清楚易懂。

